Задачи на практический выход.
1 .Вычислите объем аммиака, который можно получить, нагревая 20г хлорида аммония с избытком гидроксида кальция, если объемная доля выхода аммиака составляет 98%.
2NH 4 Cl + Ca(OH) 2 = 2NH 3 +H 2 O; Mr(NH 4 Cl) =53,5
NH 4 Cl +0,5Са(ОH ) 2 = NH 3 +0,5H 2 O
1)Рассчитаем теоретический выход
20/53,5=Х/22,4; Х=8,37л(это теоретический выход)
2) Рассчитаем практический выход
V (практического)=V (теоретического)/выход прдукта*100%
V (практического)=8,37л*98%/(делим на) 100% = 8.2л
Ответ: 8,2 л N Нз
2.Из 320г сернистого колчедана, содержащего 45% серы, было получено 405г серной кислоты (расчёт на безводную кислоту). Вычислите массовую долю выхода серной кислоты.
Составим схему производственного получения серной кислоты
320г 45% 405г, ή-?
FeS 2 → S → H 2 SO 4
1)Рассчитаем долю серы в колчедане
2)Рассчитаем теоретический выход серной кислоты

3) Рассчитаем выход продукта в процентах
З.Вычислите массу фосфора необходимую для получения 200 кг фосфорной кислоты, если массовая доля выхода продукта составляет 90%.
Составим схему производственного получения фосфорной кислоты
Х 200кг,ή=90%
P → H 3 PO 4
1)Рассчитаем массу теоретического выхода фосфорной кислоты
m
т =


2) Рассчитаем массу фосфора
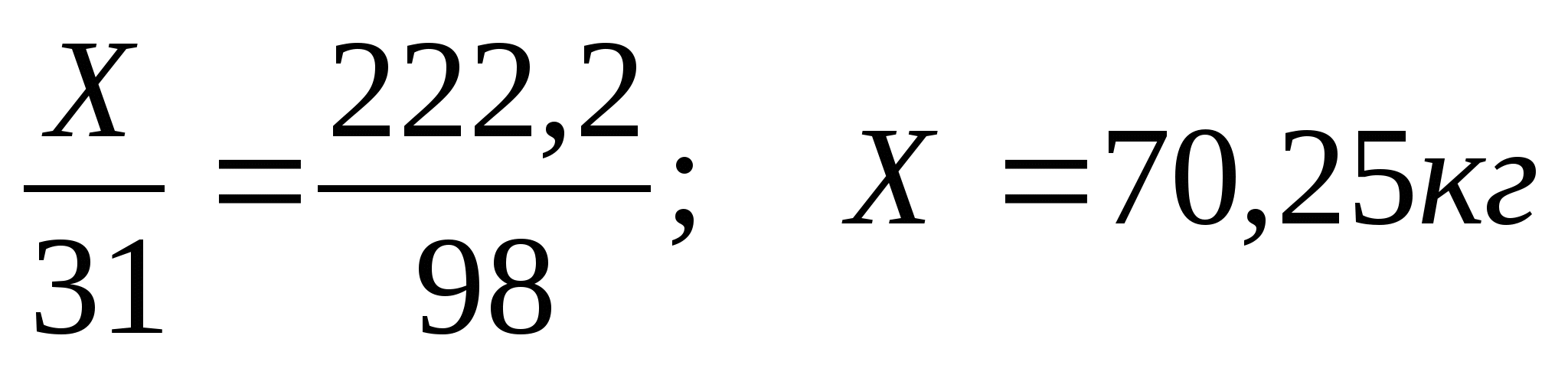
Ответ:70,Зкг
4.Юный химик на занятиях кружка решил получить азотную кислоту реакцией обмена между нитратом калия и концентрированной серной кислотой. Вычислить массу азотной кислоты, которую он получил из 20,2г- нитрата калия, если массовая доля выхода кислоты была 0,98
5.При нагревании нитрита аммония N Н 4 NO 2 образуются азот и вода. Вычислите объем азота (н. у), который можно получить при разложении 6,4г нитрита аммония, если объемная доля выхода азота составляет 89%.
6.Вычислите объем оксида азота (II), который можно получит при каталитическом окислении в лаборатории 5,6л аммиака, если объемная доля выхода оксида азота (II ) равна 90%.
7.Металлический барий получают восстановлением его оксида металлическим алюминием c образованием оксида алюминия и бария. Вычислите массовую долю выхода бария, если из 4,59 кг оксида бария было получено 3,8 кг бария.
Ответ: 92,5%
8.Определите, какая масса меди потребуется для реакции с избытком концентрированной азотной кислоты для получения 2,1 л (н. у) оксида азота (IV ), если объемная доля выхода оксида азота (IV ) равна 94%.
Ответ: 3,19
9.Какой объем оксида серы (IV ) надо взять для реакции окисления кислородом, чтобы получить оксид серы (V I) массой 20г. если выход продукт равен 80% (н.у).?
2SO
2
+ O
2
= 2SO
3
; V.(SO
2
)
=22.4
л; Mr(SO
3
) =80
1) Рассчитаем теоретический выход
m
(теорет) = 
2)Рассчитаем массу SO 2

10.При нагревании смеси оксида кальция массой 19,6г с коксом массой 20г получили карбид кальция массой 16г. Определите выход карбида кальция, если массовая доля углерода в коксе составляет 90%.
Ответ: 71.4%
11 .Через раствор массой 50г с массовой долей иодида натрия 15% пропустили избыток хлора, выделился йод массой 5,6г. Определите выход продукта реакции от теоретически возможного в %.
Ответ: 88,2%.
12.Определить выход силиката натрия в % к теоретическому, если при сплавлении 10 кг гидроксида натрия с оксидом кремния (IV ) получено 12,2 кг силиката натрия. Ответ 80%
13.Из 4 кг оксида алюминия удаётся выплавить 2 кг алюминия. Вычислите массовую долю выхода алюминия от теоретически возможного.
Ответ:94,3%
14.Вьичислите объем аммиака, который получается при нагревании смеси хлорида аммония массой 160,5 г и гидроксида кальция, если объемная доля выхода аммиака от теоретически возможного составляет 78%.
Ответ:52.4л
15.Какое количество аммиака потребуется для получения 8 т нитрата аммония, если выход продукта составляет 80% от теоретически возможного?
Ответ:2,IЗт
16.Какое количество уксусного альдегида может быть получено по реакции Кучерова, если в реакцию вступило 83,6 л ацетилена, а практический выход составил 80% от теоретически возможного?
Ответ: 131,З6г
17.Какое количество бензола потребуется для получения 738г нитробензола, если практический выход составляет 92% от теоретического.?
Ответ 508.75г
1 8.При нитрировании 46,8 бензола получено 66,42г нитробензола. Определите практический выход нитробензола в % от теоретически возможного.
19.Сколько граммов бензола можно получить из 22,4 л ацетилена, если практический выход бензола составил 40%.?
20.Какой объем бензола (ρ=0,9г/см 3) потребуется, чтобы получить 30,75г нитробензола, если выход при нитровании составляет 90% от теоретически возможного?
21 .Из 32г этилена было получено 44г спирта. Вычислите практический выход продукта в % от теоретически возможного.
22.Сколько граммов этилового спирта можно получить из 1м 3 природного газа, содержащего 6% этилена, если практический выход составил 80%?
23.Какое количество кислоты и спирта необходимо для получения 29,6г уксуснометилового эфира, если его выход составил 80% от теоретически возможного?
24.При гидролизе 500кг древесины, содержащей 50% целлюлозьг, получается 70кг глюкозы. Вычислите ее практический выход в % от теоретически возможного.
25.Сколько глюкозы получается из 250 кг опилок, содержащих 40% глюкозы. Какое количество спирта можно получить из этого количества глюкозы при 85%-ном практическом выходе?
Ответ:43,43г
26.Сколько граммов нитробензола нужно взять, чтобы восстановлением получить 186г анилина, выход которого составляет 92% от теоретического 27. Вычислите массу сложного эфира, который получили из 460г муравьиной кислоты и 460г этилового спирта. Выход эфира от теоретически возможного составляет 80%.
28.При обработке 1т фосфорита, содержащего 62% фосфата кальция, серной кислотой было получено 910,8кг суперфосфата. Определить выход суперфосфата в % по отношению к теоретическому.
Са 3 (РО 4) 2 + 2Н 2 S 0 4 = Са (Н 2 Р0 4) 2 + 2СаS 0 4
З0.Для получения кальциевой селитры, 1т мела обработали разбавленной азотной кислотой. При этом выход кальциевой селитры составил 85% по отношению к теоретическому. Сколько селитры было получено?
Ответ: 1394кг
31 .Из 56кг азота было синтезировано 48 кг аммиака. Каков выход аммиака в процентах к теоретическому.
Ответ: 70,5%
32. 34 кг аммиака пропустили через раствор серной кислоты. Выход сульфата аммония составил 90% от теоретического. Сколько килограммов сульфата аммония получено?
Ответ:118,8кг
З3.При окислении З4кг аммиака было получено 54кг окиси азота (II ).Вычислить выход окиси азота в % по отношению к теоретическому.
34.В лаборатории аммиак получают взаимодействием хлористого аммония с гашёной известью. Сколько граммов аммиака было получено, если израсходовано 107г хлористого аммония и выход аммиака составил 90% от теоретического?
Ответ:30,6г
35.Из 60кг водорода и соответствующего количества азота было синтезировано 272 кг аммиака. Каков выход аммиака в % к теоретически возможному?
36. Из 86,7г натриевой селитры, содержащей 2% примесей, получено 56,7г азотной кислоты, каков выход азотной кислоты в % к теоретически возможному?
Ответ: 90%.
37.При пропускания аммиака через 6Зкг 50% раствора азотной кислоты было получено З8кг аммиачной селитры. Каков выход ее в % к теоретически возможному?
38.Для получения фосфорной кислоты было израсходовано ЗI4кг фосфорита, содержащего 50% фосфата кальция. Выход фосфорной кислоты составил 95%.Сколько кислоты было получено?
Ответ:94,Зкг
39. 49кг 50% раствора серной кислоты было нейтрализовано гашёной известью, причем получилось 30,6кг сульфата кальция. Определить выход продукта в % к теоретическому.
40.Фосфор получают в технике по уравнению реакции;
Саз (Р0 4) 2 + 3SiО 2 +5С →ЗСaSi О 3 + 2Р +5СО
Каков выход фосфора в % к теоретическому, если его получилось 12,4 кг из 77 кг фосфорнокислого кальция?
Ответ: 80,5%
41 .Вычислите выход карбида кальция в % к теоретическому, если 15,2кг его
были получены из I4кг окиси кальция.
42. Ацетилен получают взаимодействием.карбида кальция с водой
СаС 2 +2Н 2 0= Са(ОН) 2 +С 2 Н 2
Сколько граммов ацетилена получится, если израсходовано 33,7г карбида кальция, содержащего 5% примесей и выход ацетилена составил 90% к теоретическому?
Ответ: 11,7г
43.При действии соляной кислоты на 50г мела получилось 20г углекислого газа. Каков выход его в % к теоретическому?
Ответ: 90,9%
44.При обжиге 1т известняка, содержащего 10% примесей, выход углекислого газа составил 95%. Сколько килограммов углекислого газа было получен?
Ответ: 376,2 кг.
45. Определить выход силиката натрия в % к теоретическому, если при сплавлении 10кг едкого натра с песком получено 12,2 кг силиката натрия.

РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ ПО ХИМИИ
«НА ВЫХОД ПРОДУКТА ОТ ТЕОРЕТИЧЕСКИ ВОЗМОЖНОГО»
Массовая доля выхода продукта реакции (ω - «омега»)

Многие химические реакции не доходят до конца.
При взаимодействии органических веществ часто образуются побочные продукты.
При гетерогенных реакциях часть веществ просто не вступает в реакции.
Немаловажное значение имеет оборудование, с помощью которого осуществляется химическая реакция. Негерметичность соединений всегда приводит к потерям газообразных веществ.

1. Даны массы
исходного вещества и продукта реакции.
1. Даны массы
исходного вещества и продукта реакции.
Определить выход продукта реакции.

Массовая доля выхода продукта реакции (ω - «омега»)

Многие химические реакции не доходят до конца.
При взаимодействии органических веществ часто образуются побочные продукты.
При гетерогенных реакциях часть веществ просто не вступает в реакции.
Немаловажное значение имеет оборудование, с помощью которого осуществляется химическая реакция. Негерметичность соединений всегда приводит к потерям газообразных веществ.

1. Даны массы
исходного вещества и продукта реакции.
1. Даны массы
исходного вещества и продукта реакции.
Определить выход продукта реакции.

Многие химические реакции не доходят до конца.
При взаимодействии органических веществ часто образуются побочные продукты.
При гетерогенных реакциях часть веществ просто не вступает в реакции.
Немаловажное значение имеет оборудование, с помощью которого осуществляется химическая реакция. Негерметичность соединений всегда приводит к потерям газообразных веществ.
Определить выход продукта реакции.


1) Прочитай внимательно условие задачи
2) Запиши: «Дано» и «Найти».
5) Вычисли массовую долю продукта реакции по отношению массы практической к массе теоретической, которая указана в «дано».

При действии алюминия на оксид цинка массой 32,4г получили 24 г цинка. Найдите массовую долю выхода продукта реакции.




1) Прочитай внимательно условие задачи
1) Прочитай внимательно условие задачи
2) Запиши: «Дано» и «Найти».
3) Составь уравнение реакции (не забудь расставить коэффициенты).
4) Вычисли массу теоретическую продукта реакции, по уравнению реакции.
5) Вычисли массу практическую продукта реакции, воспользовавшись обратной формулой (умножь массу теоретическую на долю выхода)

Определите массу оксида алюминия, которая может быть получена из 23,4 г гидроксида алюминия, если выход реакции составляет 92% от теоретически возможного.




Тепловой эффект химической реакции. (А 30)
1.
2Мg + O 2 = 2МgО + 1200 кДж,
выделилось 600 кДж теплоты. Объем (н.у.) вступившего при этом в реакцию кислорода равен 1) 44,8л 2) 22,4л 3) 11,2л 4) 112л
2 . В результате реакции, термохимическое уравнение которой
2Са + О 2 = 2СаО + 1270 кДж,
образовалось 56 гоксида кальция. Количество выделившейся при этом теплоты равно 1)635кДж 2) 2540 кДж 3) 317,5 кДж 4)254кДж
3 . В соответствии с термохимическим уравнением реакции
4Аl + 3O 2(г) = 2Al 2 O 3 +3352 кДж
количество теплоты, выделяющееся при сгорании 270 г алюминия, равно
1)6704кДж 2) 1340,8 кДж 3) 8380 кДж 4)838кДж
4
S + O 2 = SO 2 +297кДж,
выделилось 1188 кДж теплоты. Объем (н.у.) образовавшегося при этом сернистого газа равен 1) 44,8л 2) 89,6л 3) 890л 4) 112л
5. В результате реакции, термохимическое уравнение которой
2SO 2 + O 2 = 2SO 3 +198кДж,
выделилось 990 кДж теплоты. Масса вступившего в реакцию сернистого газа равна 1) 1280 г 2) 1600 г 3)320г 4)640г
6. В соответствии с термохимическим уравнением реакции
2СО (г) + O 2(г) = 2СO 2(г) + 568 кДж
количество теплоты, выделившейся при сгорании 11,2л (н.у.) оксида углерода (П), равно 1) 113,6 кДж 2) 142кДж 3) 284 кДж 4) 838кДж
7. В результате реакции, термохимическое уравнение которой
3КСlO 3 = 2КС1 + 3O 2 + 90 кДж,
образовалось 224 л (н.у.) кислорода. Количество теплоты, выделившейся при этом, равно 1) 450 кДж 2) 270 кДж 3) 300 кДж 4) 150кДж
8. В результате реакции, термохимическое уравнение которой
N 2 + ЗН 2 = 2NН 3 + 92 кДж,
выделилось 46 кДж теплоты. Объем (н.у.) вступившего в реакцию водорода равен 1) 67,2л 2) 44,8л 3) 11,2л 4) 33,6л
9 . В результате реакции, термохимическое уравнение которой
СН 4 + 2O 2 = СO 2 + 2Н 2 O + 802 кДж,
выделилось 160,4 кДж теплоты. Объем (н.у.) образовавшихся при этом газообразных продуктов равен
1) 4,48л 2) 8,96л 3) 13,44л 4) 11,2л
10. В результате реакции, термохимическое уравнение которой
4NH 3 + 5O 2 = 4NO + 6Н 2 O + 902кДж,
выделилось 451 кДж теплоты. Объем (н.у.) образовавшихся при этом газообразных продуктов равен 1) 112л 2) 44,8л 3) 67,2л 4) 224л
11 . В результате реакции, термохимическое уравнение которой
4NH 3 + 3O 2 = 2N 2 + 6Н 2 O + 1532 кДж,
образовалось 22,4 л (н.у.) азота. Количество выделившейся при этом теплоты равно 1) 1532кДж 2) 766 кДж 3) 306,4 кДж 4) 3064 кДж
12. В результате реакции, термохимическое уравнение которой
2Н 2 +O 2 = 2Н 2 O + 572кДж,
образовалось 7,2 г воды. Количество выделившейся при этом теплоты равно
1)114,4кДж 2) 57,2 кДж 3) 143 кДж 4) 228,8 кДж
Массовая доля растворенного вещества. (В 9)
1. К 100 г 40%-го раствора глюкозы добавили 20 мл. воды. Массовая доля глюкозы в полученном растворе равна _____________%. (Запишите число с точностью до десятых.) (33,3 %)
2 . В 80 г 20%-го раствора хлорида натрия растворили 10 г той же соли. Массовая доля хлорида натрия в полученном растворе равна _______________%. (Запишите число с точностью до десятых.) (28,9 %)
3 . В 300 г воды растворили 44,8 л аммиака (н.у.). Массовая доля аммиака в полученном растворе равна ---------------- %. (Запишите число с точностью до сотых.) (10,18 %)
4 . В 50 г воды растворили 112мл сероводорода (н.у.). Массовая доля сероводородной кислоты в полученном растворе равна ___________ %(Запишите число с точностью до сотых.) (0,34 %)
5. В 75 мл воды растворили 17,92 л хлороводорода (н.у.). Массовая доля хлороводородной кислоты в полученном растворе равна __________%. (Запишите число с точностью до целых) (28%)
6. К 25 г 10%-го раствора серной кислоты добавили 35 г 20% раствора серной кислоты. Массовая доля серной кислоты в полученном растворе равна ___ %. (Запишите число с точностью до сотых.) (15,83 %)
7. К 40 мл 20%-го раствора нитрата калия (плотность 1,13 г/мл) добавили 30 мл 10%-го раствора той же соли (плотность 1,06 г/мл). Массовая доля нитрата калия в полученном растворе равна _________ %. (Запишите число с точностью до десятых.) (15,9 %)
8 . К 50 мл 22%-го раствора гидроксида калия (плотность 1,20 г/мл) добавили 70 мл 8%-го раствора той же соли (плотность 1,07 г/мл). Массовая доля гидроксида калия в полученном растворе равна ________%. (Запишите число с точностью до десятых.) (14,2 %)
9 . Какую массу воды надо добавить к 120 г 30%-го раствора соляной кислоты для получения 15%-го раствора? Ответ: _________ г. (Запишите число с точностью до целых.) (120 г)
10. Какую массу сульфата магния надо добавить к 150 г 10%- го раствора этой соли для получения 18%-го раствора? Ответ: __________г. (Запишите число с точностью до сотых.) (14,63 г)
11 . Какую массу 12%-го раствора сульфата меди (II) надо добавить к 60 г 4%-го раствора этой соли для получения 10%-го раствора? Ответ:_______ г. (Запишите число с точностью до целых.) (180 г)
12. Сколько граммов 8%-го и 14%-го раствора хлорида кальция надо взять для приготовления 100 г 12%-го раствора этой соли? (8% - 33,33 г; 14% - 66,67 г)
13. Какой объем 30%-го раствора бромида калия (плотность 1,26 г/мл) и 12%-го раствора этой же соли (плотность 1,09 г/мл) надо взять для приготовления 200 г 15%-го раствора? (30% - 26,455 мл; 12% - 152,9 мл)
14. Масса кислорода, содержащегося в 200 г раствора карбоната натрия с массовой долей 10,6%, равна _________г. (Запишите число с точностью до десятых.) (9,6 г)
15. Масса кальция, содержащегося в 410 г раствора нитрата кальция с массовой долей 2%, равна _________г. (Запишите число с точностью до целых.) (2 г)
Задачи на выход продукта реакции от теоретически возможного.
1 . При взаимодействии натрия количеством вещества 0,5 моль с водой получили водород объемом 4,2 л. Вычислите практический выход газа (%). (75%.)
2 . Металлический хром получают восстановлением его оксида Сг 2 О 3 металлическим алюминием. Вычислите массу хрома, который можно получить восстановлением его оксида массой 228 кг, если практический выход хрома составляет 95%. (148,2 кг.)
3. При сплавлении гидроксида натрия массой 60 г и оксида кремния (IV) образовалось 13 г водяных паров. Определите практический выход воды. (96,3%.)
4. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объемом 3,0 л (н. у.), если выход оксида серы (IV) составляет 90%. (9,51 г.)
5. Вычислите объем аммиака, который можно получить, нагревая хлорид аммония массой 20 г с избытком гидроксида кальция, если выход аммиака составляет 98%. (8,2 л.)
6. При пропускании аммиака объемом 672 л (н. у.) через раствор массой 900 г с массовой долей азотной кислоты 40% получен нитрат аммония массой 440,68 г. Определите выход соли. (96%.)
7. Из фосфора массой 15,5 кг получили фосфорную кислоту массой 41,6 кг. Вычислите выход продукта. (85%.)
8. Какое количество серной кислоты можно получить из серы массой 192 г, если выход на последней стадии 95%? (5,7 моль.)
9. При пропускании сероводорода объемом 2,8 л (н. у.) через избыток раствора сульфата меди (II) образовался осадок массой 11,4 г. Определите выход продукта реакции. (95%.)
10. Через раствор массой 50 г с массовой долей иодида натрия 15% пропустили избыток хлора. Выделился иод массой 5,6 г. Определите выход продукта реакции. (88,2%.)
11. К раствору, содержащему хлорид кальция массой 4,5 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88%. (3,41 г.)
12. Вычислите, какой объем раствора с массовой долей гидроксида калия 26% (р = 1,24 г/мл) необходим для реакции с алюминием, чтобы получить водород объемом 10,64 л, если выход водорода составляет 95%. (57,32 мл.)
13. Определите количество вещества и объем I (н. у.) хлора, который потребуется для получения хлорида железа (III) массой 150 г при выходе соли 92,3%. (1,5 моль; 33,6 л.)
14. При термическом разложении метана количеством 14 моль получен ацетилен, объем которого при (н. у.) составил 120,96 л. Вычислите выход продукта. (77%.)
15. Вычислите массу ацетата натрия, затраченную на получение метана массой 80 г при выходе продукта 70%. (586 г.)
16. Определите массу уксусной кислоты, которая расходуется для синтеза этилацетата, если полученная масса эфира 70,4 г составляет 80% от теоретического. (60 г.)
17. Рассчитайте массу тетрахлорида углерода, который можно получить при хлорировании метана объемом 11,2 л молекулярным хлором, объем которого равен 56 л (н. у.). Выход продукта составляет 70%. (53,9 г.)
18. При каталитическом гидрировании формальдегида получили метиловый спирт, при взаимодействии которого с металлическим натрием образовался водород объемом 8,96 л (н. у.). Выход продукта на каждой стадии синтеза составил 80%. Определите исходную массу формальдегида. (37,5 г.)
Избыток и недостаток реагентов
Далеко не всегда берут пропорциональные количества и массы реагирующих веществ. Часто один из реагентов для реакции берется с избытком , а другой – с недостатком . Очевидно, если в реакции 2Н 2 + О 2 = 2Н 2 О для получения 2 моль Н 2 О взять не 1 моль О 2 и 2 моль Н 2 , а 2 моль Н 2 и 2 моль О 2 , то 1 моль О 2 реагировать не будет и останется в избытке.
Определение реагента, взятого в избытке (например, В), проводят по неравенствам: n A / a < n общ.В /b = (n B + n изб.В)/b , где n общ.В – общее (взятое в избытке) количество вещества, n B – необходимое для реакции количество вещества, т.е. стехиометрическое , и n изб.В – избыточное (не реагирующее) количество вещества В , причем n общ.В = n B + n изб.В.
Вследствие того что избыточное количество реагента В реагировать не будет, расчет получаемых количеств продуктов необходимо проводить только по количеству реагента , взятого в недостатке.
Практический выход продукта
Теоретическим количеством n теор. называется количество продукта реакции, которое получается в соответствии с расчетом по уравнению реакции. Однако в конкретных условиях проведения реакции может произойти то, что продукта образуется меньше, чем ожидалось по результатам уравнения реакции; назовем эту величину практическим количеством n пр.
Практическим выходом продукта называется отношение практического количества продукта В (полученного реально) к теоретическому (рассчитанному по уравнению реакции). Практический выход продукта обозначается как ŋ В : ŋ В = n пр.В /n теор.В (аналогичный вид имеют выражения для массы любого продукта и объема газообразного продукта).
Практический выход продукта представлен долей от единицы или от 100 %.
На практике чаще всего ŋ В < 1 (100 %) из-за того что n пр. < n теор. Если в идеальных условиях n пр. = n теор, то выход становится полным, то есть ŋ В = 1 (100 %) ; он часто называется теоретическим выходом.
Массовая доля вещества в смеси. Степень чистоты вещества
Чаще для проведения реакций берут не индивидуальные вещества, а их смеси, в том числе и природные – минералы и руды. Содержание каждого вещества в смеси выражается посредством его массовой доли.
Отношение массы вещества (m B ) к массе смеси (m см ) получило название массовой доли вещества В (w В) в смеси: w В = m B /m см.
Массовая доля вещества в смеси – это доля от единицы или от 100 %.
Сумма массовых долей всех веществ смеси равна 1 (100 %).
В смеси мы сталкиваемся с двумя видами веществ – основным веществом и примесями . Основным веществом называют вещество (В), которое в смеси находится в преобладающем количестве; все остальные вещества называются примесями , а величину w В считают степенью чистоты основного вещества.
Например, природный карбонат кальция
– известняк
– может содержать 82 % CaCO 3 .
Иными словами, 82 %
равна степень чистоты известняка по CaCO 3 .
На различные примеси (песок, силикаты и др.)
приходится ос таток в 18 %.
таток в 18 %.
В полезных ископаемых, рудах, минералах, горных породах, т.е. в природных соединениях, и в продуктах промышленного производства примеси содержатся всегда.
Степень очистки химических реагентов может быть разной. По уменьшению процентного содержания примесей качественно различают следующие типы реактивов: «чистые», «технические», «химически чистые», «чистые для анализа», «особо чистые». Например, 99, 999 % основного вещества (H 2 SO 4) содержит «химически чистая» серная кислота . Следовательно, в серной кислоте лишь 0,001 % примесей.
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Алгоритм VII. Определение массовой или объемной доли выхода продукта реакции (в%) от теоретически возможного
Задача VII.1.
| Последовательность действий | При термическом разложении метана массой 32 г на углерод и водород образовался водород объемом 7,5л (н.у.). Вычислите объемную долю (%) выхода водорода от теоретически возможного |
| Дано: m(CH4) = 32 г V пр (Н2)= 7,5 л Найти: φ (H2)- ? |
|
| C Н 4 = C + 2 H 2 |
|
| C Н 4 = C + 2 H 2 1 моль 2 моль 22,4 л/моль |
|
| Mr (CH4) =16 г/моль |
|
| По уравнению реакции 1 моль CH4 - 2 моль H2 По условию 2 моль CH4 - 4 моль H2 |
|
| Определить объем теоретический водорода | Vтеор(H2)=Vm*n(H2) Vтеор(H2)= 22?4 л/моль*2 моль=44,8 л |
| Найти объемную долю (%) выхода водорода от теоретически возможного | φ (H2)=Vпр(H2)/Vтеор*100% φ (H2)=7,5 л/44,8 л*100%=16,7% |
| Сформулировать ответ | Объемная доля (%) выхода водорода от теоретически возможного при термическом разложении метана массой 32 г на углерод и водород с образованием водорода объемом 7,5л (н.у.) составляет 16,7 % |
Задача VII.2.
| Последовательность действий | В результате прямой гидратации 112 м3 (н.у.) этилена получили 172,5 кг этилового спирта. Вычислить выход спирта (%) от теоретически возможного |
| Кратко записать условие задачи | Дано: V(C2H4)=112 м3 m(C2H5OH)=172,5 кг Найти: φ (C2H5OH)- ? |
| Записать уравнение реакции, подчеркнуть формулы тех веществ, которые используются в решении | C 2 Н 4 +H2O = C 2 H 5 OH |
| Записать данные задачи и искомые над формулами, под формулами – количественные характеристики, необходимые для расчетов в соответствии с уравнением | 112 м3 172,5 г, X% C 2 Н 4 +H2O = C 2 H 5 OH 1 моль 1 моль |
| Найти относительные молекулярные массы, молярные массы веществ, используемых при решении задачи | Mr (C2H5OH)=46 г/моль=0,046 кг/моль |
| Найти количества веществ, вступающих в реакцию | По уравнению реакции 1 моль CH4 - 1 моль H2 По условию nтеор (C2H5OH)= n теор (C2H4) |
| n теор (C2H4)=V/Vm n теор (C2H4)=112*10л/22,4 л/моль=5000 моль nтеор (C2H5OH)=5000 моль |
|
| Найти объемную долю (%) выхода спирта от теоретически возможного | φ (C2H5OH)=172,5кг/5000 моль*0,046 кг/моль * 100%=75% |
| Сформулировать ответ | Выход спирта (%) от теоретически возможного в результате прямой гидратации 112 м3 (н.у.) этилена, в результате которой получили 172,5 кг этилового спирта составит 75% |
Задача VII.3.
| Последовательность действий | Какой объем (н.у.) этилена можно получить при каталитической дегидрировании 1,5 т этана, если выход продукта реакции составляет 90 % от теоретически возможного? |
| Кратко записать условие задачи | Дано: φ (C2H4)=90% m(C2H6)=1500 кг Найти: V (C2H4) -? |
| Записать уравнение реакции, подчеркнуть формулы тех веществ, которые используются в решении | C 2 Н 6 = C 2 H 4 + H2 |
| Записать данные задачи и искомые над формулами, под формулами – количественные характеристики, необходимые для расчетов в соответствии с уравнением | C 2 Н 6 = C 2 H 4 + H2 1 моль 1 моль |
| Найти относительные молекулярные массы, молярные массы веществ, используемых при решении задачи | Mr (C2H6)=30 г/моль=0,03 кг/моль |
| Найти количества веществ, вступающих в реакцию | По уравнению реакции 1 моль CH4 - 1 моль C2H6 По условию nтеор (CH4)= n теор (C2H6) |
| Определить количество вещества этилена и этилового спирта | n теор (C2H6)=m/M n теор (C2H6)=1500кг/0,03 кг/моль=50000 моль nтеор (C2H4)=50000 моль |
| Найти V пр этилена | Vпр (C2H4)= n (C2H4)* V теор *φ/100% Vпр (C2H4)=50000*22,4*90/100=1008000л |
| Сформулировать ответ | При каталитической дегидрировании 1,5 т этана, если выход продукта реакции составляет 90 % от теоретически возможного, можно получить 1008000 л этилена |
Задачи для самостоятельного решения.
Задача VII.4. Какую массу пропилового спирта потребуется окислить для получения 13,92 г пропионового альдегида, если выход последнего составляет 80% от теоретически возможного?
Задача VII.5. Газ, образующийся при нагревании 29,95 мл предельного одноатомного спирта с концентрированной серной кислотой, присоединяет 8,96 л водорода в присутствии катализатора. Определите молекулярную формулу исходного спирта, если выход углерода составляет 90 % от теоретического
Задача VII.6. Один из методов получения уксусной кислоты заключается в каталитическом окислении бутана. Какую массу раствора уксусной кислоты концентрацией 90% можно получить окислением 100 л бутана, если выход целевого продукта 65%?
Задача VII.7. При гидрировании этилена объемом 20 л (н.у.) получили 18 л этана. Рассчитайте объемную долю выхода этана
Задача VII.8. При пропускании 7 л этилена с водородом над нагретым катализатором получили 6 л этана. Вычислите объемную долю (%) выхода этана от теоретического. Объемы газов измерены при н.у.
Задача VII.9. Вычислите массовую долю в % выхода бензола от теоретически возможного, если известно, что из 11,2 л ацетилена (н.у.) было получено 10 г бензола
Задача VII.10. В лаборатории из 156 г бензола при реакции нитрования было получено 220 г нитробензола. Каков выход нитробензола (%) от теоретически возможного?








